在新冠疫苗竞争格局基本尘埃落定的情况下,越来越多的企业将注意力转移至了新冠治疗市场。
受辉瑞新冠口服药获中国药监局附条件批准的消息影响,2月14日,只要与其“沾亲带故”的有关概念股均全线大涨。
其中,腾博股份(300363.SZ)开盘一字涨停,凯莱英(002821.SZ;06821.HK)A股也大涨5.52%,H股则微跌0.94%。相关原料概念股同样大涨,雅本化学(300261.SZ)和精华制药(002349.SZ)均涨停。
2月11日,国家药监局根据《药品管理法》相关规定,按照药品特别审批程序,进行应急审评审批,附条件批准辉瑞公司新冠病毒治疗药物奈玛特韦片/利托那韦片组合包装(即Paxlovid)进口注册。国家药监局要求上市许可持有人继续开展相关研究工作,限期完成附条件的要求,及时提交后续研究结果。
被Paxlovid获批消息刺激到的,还有复星医药(600196.SH;02196.HK)。2月14日,复星医药A股开盘后小幅上涨接近2%,随后逐渐走低,最终报收41.58元/股,与上一个交易日持平。这一数字与历史最高点相比已经腰斩。
作为辉瑞新冠mRNA疫苗“复必泰”在中国地区的唯一合作商,头顶“新冠疫苗股”光环的复星医药曾经在一年内暴涨超过100%。2021年7月,复星医药在股东大会上回复投资者问询时表示,国家药监局对复必泰的专业审评已经通过,正在进行行政审批,但截至目前,其审批进度仍未更新。而Paxlovid的获批能否给“复必泰”带来新的希望,仍是一个未知数。
“真伪”概念股
辉瑞Paxlovid是一款口服小分子新冠病毒治疗药物,用于治疗成人伴有进展为重症高风险因素的轻至中度新型冠状病毒肺炎(COVID-19)患者,例如伴有高龄、慢性肾脏疾病、糖尿病、心血管疾病、慢性肺病等重症高风险因素的患者。
这是第一款在中国大陆地区获得批准的新冠口服药。早在2021年12月22日,美国食品药品管理局(FDA)便授予了Paxlovid紧急使用权。随后,Paxlovid又陆续在英国、德国、加拿大等国家获得紧急使用授权。
辉瑞表示,根据截至1月下旬已经签订的合约和承诺交付的疗程数,预计2022年内Paxlovid的销售收入可以达到220亿美元。

实际上,在Paxlovid获得国家药监局批准前,国内有不少药企就已经手握Paxlovid的大额订单。
就在Paxlovid获得国家药监局批准的同一天,2月11日,博腾股份公告称,公司收到辉瑞的采购订单,为其提供CDMO(合同定制研发生产)服务,这笔订单价值6.81亿美元。这接近于腾博股份一年营收的1/3,全年净利润的两倍。
财报数据显示,2020年,腾博股份的营业收入为20.72亿元,净利润为3.24亿元。腾博股份和辉瑞的订单将会在2022年交付,腾博股份表示,订单的执行预计将会对公司2022年的营业收入和营业利润产生积极影响。
2021年11月,凯莱英先后发布两份公告,公司与某大型制药公司签订了一款小分子化学创新药物的合作合同,为该公司提供CDMO服务。截至目前,凯莱英关于这款小分子药物的合同金额已经累计接近60亿元。凯莱英并未透露合作方的具体情况,但据业界猜测,这款小分子药物正是辉瑞Paxlovid。
今天股价大涨的个股中,也包括Paxlovid的原料概念股。
Paxlovid主要成分包括3CL蛋白酶抑制剂Nirmatrelvir和低剂量利托那韦(Ritonavir)。Nirmatrelvir是一种新冠病毒3CL蛋白酶抑制剂,用于阻断新冠病毒3CL蛋白酶的活性,以达到破坏新冠病毒后续RNA复制的效果,利托那韦的主要作用则是帮助Nirmatrelvir维持在人体里的活性。
雅本化学是卡龙酸酐的生产商之一,这是一种Paxlovid生产所需要的医药中间体。虽然多次表示与辉瑞无直接供货关系,但雅本化学仍然被投资者冠以Paxlovid原料供应商之名,股价也随之暴涨,成为过去两个月里受关注度最高的“妖股”之一。
精华制药的子公司森萱医药则是利托那韦中间体的生产商之一,因此也顺理成章地被划入Paxlovid概念股的阵营。事实上,精华制药早就已经公告澄清过,子公司未与辉瑞签订购销合同,但这仍然无法抵挡投资者的热情追捧。
国产新冠口服药在研至少11款
Paxlovid的获批展现了新冠病毒口服药潜在的巨大市场。在新冠疫苗竞争格局基本尘埃落定的情况下,越来越多的企业将注意力转移至了新冠治疗市场。
据时代财经不完全统计,目前国内至少11款在研的新冠病毒口服药。其中,进展最快的是君实生物(688180.SH;01877.HK)研发的VV116和开拓药业(09939.HK)的普克鲁胺。
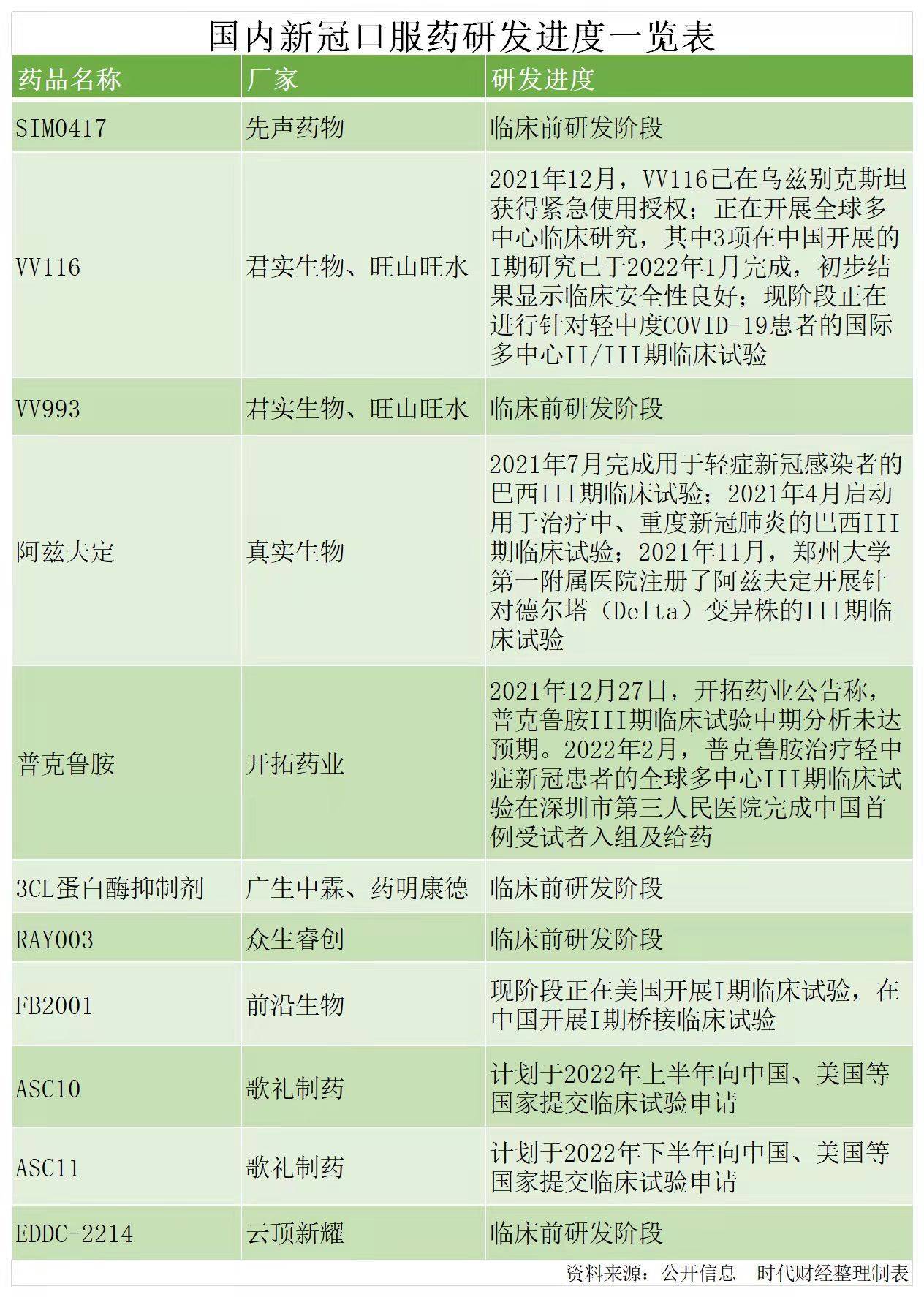
2021年12月,VV116就已经在乌兹别克斯坦获得了紧急使用授权,目前正在开展全球多中心临床研究,其中3项在中国开展的I期研究已于2022年1月完成。初步结果显示,VV116的临床安全性良好,这也是目前国内唯一获批进入临床试验阶段的新冠小分子药物。
君实生物方面曾表示,在通过临床试验后,将会第一时间启动NDA(新药注册)申请。
普克鲁胺则于2021年7月获得巴拉圭的紧急使用授权,并且在海外开展的多中心临床试验已经接近尾声。不过,普克鲁胺III期临床试验中期分析未达预期。2021年12月27日,开拓药业公告称,普克鲁胺III期临床试验的中期分析未达到统计学显著性,该消息引发开拓药业股价大跳水,市值一日之内蒸发超百亿港元。
开拓药业方面对时代财经表示,中期分析结果不理想,与美国当地疫情进展、试验入组人群组成等因素都有关系。目前,开拓药业正在寻求FDA的同意,对临床方案进行调整,继续对美国市场发起冲击。
2月11日,开拓药业公告称,普克鲁胺已经在深圳第三人民医院完成了中国首例针对轻中症患者的III期临床试验。2月14日,开拓药业应声大涨,最终报收12.10港元/股,涨21.73%。

















